- Menú
- Nosotros
-
Complementos alimenticios
- Marcas
- Puntos de venta
- Saber más
- Noticias
- Contacto
-
Contacto
info@smimport.com
Hazte Cliente de SM IMPORT
Entrega
en 24/48hAtención
personalizadaAsesoramiento
Técnico ProfesionalMás de 7 Mil
Clientes Satisfechos
Comprensión del mecanismo de acción del ácido D-glucárico.
Publicado :
08/05/2023 12:19:20
Categories :
Artículos

La salud muscular y la hepática son sistemas íntimamente interconectados. Se ha demostrado que el dolor muscular aumenta los biomarcadores de daño y toxicidad hepática, y que la detoxificación del hígado favorece la recuperación muscular.
El ácido D-glucárico (GA) es un compuesto natural que puede mejorar el proceso de limpieza metabólica y ayudar a la biotransformación de sustancias. La ingesta de las sales dietéticas de glucarato de calcio o de potasio, aumentan el nivel del GA en el suero. Se ha demostrado que el GA y su derivado el D-ácido sacárico-1,4-lactona (DSL) tienen efectos hepatoprotectores, antiinflamatorios, reductores del colesterol, antioxidantes y anticancerígenos.
El objetivo de este estudio es identificar, in silico, los posibles mecanismos moleculares involucrados en la detoxificación hepática y predecir cuantitativamente el efecto del GA en este proceso mediante metodologías modernas de bioinformática y biología de sistemas computacionales (CytoSolve®).
REVISIÓN SISTEMÁTICA DE LA LITERATURA PARA IDENTIFICAR LAS VÍAS MOLECULARES DE TOXICIDAD HEPÁTICA Y PROPIEDADES FARMACOCINÉTICAS Y FARMACODINÁMICAS DEL GA
De un conjunto inicial de 119 artículos, 85 artículos fueron relevantes, 45 informaron sobre las 4 vías moleculares relacionadas con la toxicidad hepática, 29 informaron sobre las interacciones bioquímicas entre los fitonutrientes y las vías moleculares relacionadas con la toxicidad hepática y 19 informaron sobre las propiedades farmacocinéticas y farmacodinámicas del GA. En los artículos seleccionados se identificaron cuatro vías involucradas en la toxicidad hepática que incluyen la vía de producción de especies reactivas de oxígeno (EROs), la vía de desconjugación/desglucuronidación, la vía de apoptosis hepática y la síntesis de la β-glucuronidasa
Vía de producción de EROs en toxicidad hepática
Los EROs producidos por el alcohol, el lipopolisacárido (LPS), por el citocromo P450 y la actividad de la nicotinamida adenina dinucleótido fosfato oxidasa (NADPH+) agravan la respuesta celular a las toxinas al aumentar considerablemente la transducción de señales a través de factores de transcripción, como el factor nuclear kappa-B (NF-κB) y STAT3. Además, el exceso de EROS inhibe vías de señalización hepatoprotectoras como la AMPK e inhiben factores de transcripción relacionados con la síntesis endógena de enzimas antioxidantes como el factor nuclear eritroide 2 (Nrf2).
Vía de desconjugación/desglucuronidación en toxicidad hepática
La glucuronidación de varias toxinas es una parte importante de la reacción de conjugación de Fase II y está catalizada por la enzima UDP glucuronato β-D-glucuronosiltransferasa (UDPGT). Las toxinas de la bilis o del hígado formarán conjugados al unirse al ácido glucurónico. Estos conjugados se excretan en la bilis y en la orina o se transportan desde el hígado a otros tejidos. La reacción opuesta a esto es la desglucuronidación, la desactivación y la eliminación de los conjugados de glucurónido. Esta reacción mediará la reabsorción de fracciones conjugadas en el hígado en lugar de su excreción, lo que aumentará la toxicidad hepática. La desglucuronidación es catalizada por la enzima β-glucuronidasa, presente en la mayoría de los tejidos, particularmente en el hígado, los riñones, el bazo, el epitelio intestinal y los órganos endocrinos y reproductivos. Así, la inhibición de la actividad de la β-glucuronidasa en el hígado puede ser un mecanismo hepatoprotector, previniendo así el daño hepático por toxicidad.
Vía de apoptosis hepática en toxicidad hepática
Uno de los mecanismos hepatotóxicos clave es la apoptosis hepática, que está mediada por TNF-α o Fas a través de vías de activación mitocondrial. En los hepatocitos, factores como la administración aguda de etanol pueden iniciar la apoptosis al aumentar la cantidad de expresión de la proteína Fas, que inducirá la liberación del citocromo C de la mitocondria al citosol y este a su vez, acabará activando el apoptosoma.
Vía de síntesis de la β-glucuronidasa en toxicidad hepática
La actividad incrementada de la β-glucuronidasa promueve la desconjugación de endotoxinas y la formación de bilirrubinato de calcio en el hígado, lo que a su vez aumenta el daño hepático mediado por hepatotoxicidad. El LPS, una de las principales endotoxinas de las bacterias gram negativas, induce una mayor expresión de β-glucuronidasa endógena en hepatocitos y células epiteliales biliares intrahepáticas.
RESULTADOS DE LA SIMULACIÓN IN SILICO
El efecto del GA se probó en los cuatro modelos de las vías moleculares encontradas en la revisión sistemática y los resultados se analizan en detalle a continuación.
Efecto del ácido glucárico en la producción de EROs
El efecto del GA se simuló en la ruta de producción de EROs mediante la estimación de los niveles de EROs en los hepatocitos durante un período de dos días. Los niveles de EROs fueron inducidos por la toxicidad del alcohol en las simulaciones. Los niveles de suplementación de GA utilizados en las simulaciones fueron 0, 1,8 y 26 mg. Bajo condiciones de control, se asumió que el sistema estaba en un estado de toxicidad hepática inducida por alcohol sin suplementos de GA, y los niveles de EROs se estimaron en 70 nM. El aumento de la suplementación con GA a 1,8 mg condujo a una disminución significativa en los niveles de EROs a 16 nM. Estos resultados corroboran el papel del GA como hepatoprotector a través de la reducción de EROs. La producción de EROs está implicada en la promoción de la expresión de citoquinas proinflamatorias que causan daño hepático y exacerban la toxicidad hepática. Un aumento en la suplementación con GA a 26 mg, 52 mg y 120 mg no redujo más los niveles de EROs.
Efecto del ácido glucárico sobre la desconjugación/desglucuronidación
El efecto del GA se simuló en la ruta de desconjugación estimando los niveles del desconjugado de glucurónido en la bilis durante un período de dos días. Se realizaron simulaciones para niveles de suplementación de GA de 0, 26 mg y 52 mg. En condiciones de control, se supuso que el sistema estaba en un estado infeccioso con niveles elevados de endotoxinas sin suplementos de ácido glucárico, y se estimó que los niveles de desconjugado de glucurónido eran 4,9 × 10−3 nM. El aumento de la suplementación con GA a 26 mg condujo a una disminución significativa en los niveles de desconjugado de glucurónido a 1,7 × 10-5 nM al final del período de simulación. Estos resultados indican que el GA juega un papel hepatoprotector al reducir los niveles de desconjugado de glucurónido, que están implicados en la promoción de la toxicidad hepática y el daño hepático posterior. Esto se puede atribuir a la inhibición de la β-glucuronidasa por parte del GA, que cataliza la desconjugación de los complejos de endotoxina y ácido glucurónico. Un aumento en la suplementación con GA a 52 mg redujo aún más los niveles de desconjugado de glucurónido a 8,9 × 10-6 nM. La suplementación con GA de 1,8 mg no redujo los niveles de desconjugado de glucurónido en comparación con el valor de control. Un aumento adicional en la suplementación con GA a 52 mg no redujo más los niveles de desconjugado de glucurónido.
Efecto del GA sobre la apoptosis hepática
Para analizar el efecto del GA en la apoptosis hepática, estimamos los niveles de cPARP (un marcador de apoptosis) en niveles variables de GA durante un período de dos días. En condiciones de control, se supuso que el sistema estaba en un estado infeccioso con citocinas proinflamatorias elevadas que simulaban un entorno proapoptótico con niveles estimados de cPARP de 1217 nM. El GA redujo los niveles de cPARP de forma dependiente de la dosis a 1211, 1208 y 1202 nM para la suplementación con GA de 26, 52 y 120 mg, respectivamente. Estos resultados muestran un efecto moderado pero constante en la reducción de cPARP, lo que indica un papel moderado de GA en la reducción de la apoptosis hepática. El nivel de dosis de GA de 1,8 mg no redujo el nivel de cPARP en comparación con el valor de control.
Efecto del GA en la síntesis de la β-glucuronidasa
El efecto del GA se simuló en la ruta de síntesis de la β-glucuronidasa mediante la estimación de los niveles de β-glucuronidasa en el hepatocito durante un período de dos días. Se realizaron simulaciones para niveles de suplementación de GA de 0, 26 mg y 52 mg. En condiciones de control, se supuso que el sistema estaba en un estado infeccioso con niveles elevados de endotoxinas sin suplementación con GA, y se estimó que los niveles de β-glucuronidasa eran 4,75 nM. El aumento de la suplementación con GA a 26 mg condujo a una disminución significativa en los niveles de la β-glucuronidasa a 1,19 nM al final del período de simulación. Estos resultados indican que el GA juega un papel hepatoprotector al reducir los niveles de β-glucuronidasa, lo que está implicado en promover la acumulación de toxinas y el daño hepático posterior. Un aumento adicional en la suplementación con GA a 52 mg no redujo más los niveles de EROs.
Este estudio ha utilizado un enfoque de biología de sistemas computacionales CytoSolve® (estudio in silico) para descubrir los mecanismos de cómo los metabolitos de las sales glucáricas pueden modular las vías moleculares de desintoxicación del hígado, como se muestra en la Figura 1. Los resultados del estudio muestran que el metabolito de las sales de glucarato, GA, mitiga la toxicidad hepática al: (1) reducir la producción de EROs en los hepatocitos, (2) reducir la apoptosis hepática, (3) reducir la β-glucuronidasa en los hepatocitos y (4) reducir niveles del desconjugado de glucurónido en la bilis.
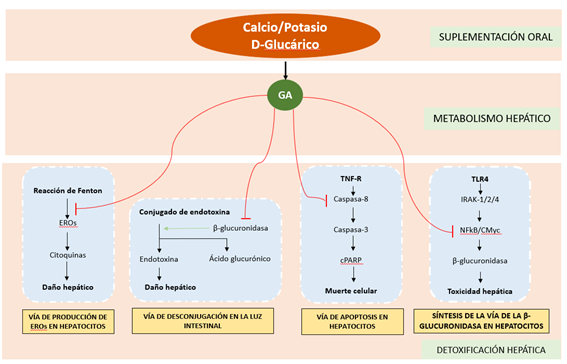
Figura 1. Interacciones moleculares de los metabolitos activos del glucarato de calcio/potasio, GA, sobre los cuatro mecanismos de desintoxicación del hígado.
En conclusión, hasta donde se sabe, este es el primer estudio de este tipo, in silico, que identifica los mecanismos de acción críticos detrás de la mitigación de la toxicidad hepática por GA observados en estudios experimentales. Los resultados de este estudio muestran que el GA mitiga la toxicidad hepática al regular a la baja la producción de EROS, suprimir la acumulación de desconjugados, inhibir la apoptosis hepática y reducir la síntesis de β-glucuronidasa. Si bien el modelo actual proporciona una explicación mecánica para las observaciones experimentales, los futuros estudios experimentales in vitro o in vivo pueden servir para fortalecer aún más las conclusiones de este estudio. El marco computacional modular proporcionado por el estudio permite la expansión e integración continua de otras vías relevantes. Por ejemplo, la vía molecular de la toxicidad hepática inducida por la disfunción mitocondrial podría integrarse para expandir el modelo de toxicidad hepática y mejorar su solidez. Las interacciones de los derivados de GA como el DSL también se pueden explorar en trabajos futuros. Finalmente, este estudio proporciona un marco para futuras investigaciones para mejorar nuestra comprensión de cómo otros nutrientes pueden individualmente o en combinación con GA, apoyar la detoxificación hepática y mejorar la salud muscular, así como otras patologías hepáticas como la hepatitis, la cirrosis hepática y la esteatohepatitis no alcohólica.
Ayyadurai VAS, Deonikar P, Fields C. Mechanistic Understanding of D-Glucaric Acid to Support Liver Detoxification Essential to Muscle Health Using a Computational Systems Biology Approach. Nutrients. 2023 Feb 1;15(3):733. doi: 10.3390/nu15030733. PMID: 36771439; PMCID: PMC9921405.
Share this content
Categorías
Busca en el blog
Videoblog
-
Directo Instagram Salud Vascular
Publicado : 17/03/2022 18:21:05 | Categories : Videoblogiframe width="560" height="315" src="https://www.youtube.com/embed/jvQ2BzqXGbs" title="YouTube video player" frameborder="0" allow="accelerometer; autoplay; clipboard-write; encrypted-media; [...]








 Efectos del extracto de azafrán (AFFRON®) sobre...
Efectos del extracto de azafrán (AFFRON®) sobre...
 Análisis farmacocinético de formulaciones...
Análisis farmacocinético de formulaciones...
 EFECTIVIDAD DE LOS INGREDIENTES NUTRICIONALES...
EFECTIVIDAD DE LOS INGREDIENTES NUTRICIONALES...
 PIRROLOQUINOLINA QUINONA, MÁS QUE UN ANTIOXIDANTE
PIRROLOQUINOLINA QUINONA, MÁS QUE UN ANTIOXIDANTE
 Inhibición de la formación de biopelículas de...
Inhibición de la formación de biopelículas de...